L'élément le plus lourd jamais étudié chimiquement
Des expériences permettent de déterminer les propriétés du moscovium et du nihonium
Une équipe internationale dirigée par des scientifiques du GSI/FAIR de Darmstadt, de l'université Johannes Gutenberg de Mayence et de l'institut Helmholtz de Mayence a réussi à déterminer les propriétés chimiques des éléments superlourds moscovium et nihonium (éléments 115 et 113) produits artificiellement. Le moscovium devient ainsi l'élément le plus lourd jamais étudié chimiquement. Les deux éléments nouvellement caractérisés sont chimiquement plus réactifs que le flérovium (élément 114), qui avait été étudié précédemment au GSI/FAIR. Les résultats sont publiés dans la revue Frontiers in Chemistry.
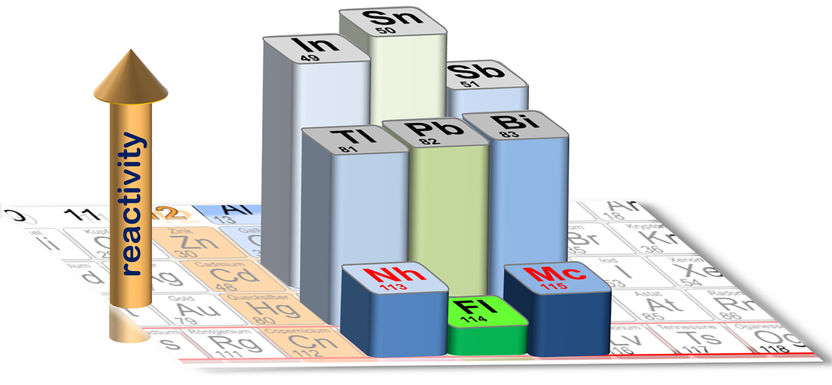
Découpe du tableau périodique : La hauteur des barres des éléments surlignés représente la force de la liaison sur une surface de quartz.
A. Yakushev/Ch.E. Düllmann
Grâce à ce résultat, les expériences menées au GSI/FAIR fournissent désormais des données sur les trois éléments superlourds 113, 114 et 115, ce qui permet une classification fiable de leurs propriétés et une évaluation de la structure du tableau périodique dans cette région extrême. Lorsque les éléments deviennent plus lourds, les nombreux protons présents dans le noyau accélèrent les électrons qui tournent autour du noyau à des vitesses de plus en plus élevées, à tel point que seuls les effets de la célèbre théorie de la relativité d'Einstein entrent en jeu. La vitesse pure rend les électrons plus lourds.
Dans le plomb (élément 82), par exemple, les effets de ces processus sont déjà à l'œuvre et contribuent aux processus chimiques des batteries au plomb. Les voisins de gauche et de droite - le thallium et le bismuth - se comportent différemment. L'effet, bien que faible, est localisé au niveau du plomb. Un élément super-lourd pourrait-il remplacer le plomb ? Qu'en est-il du voisin le plus lourd du tableau périodique, le flérovium, l'élément 114, découvert et étudié chimiquement au cours des 20 dernières années seulement ? Il s'est avéré très différent du plomb, se transforme facilement en gaz et est moins réactif chimiquement.
Pour trouver des réponses, il fallait également tester ses deux voisins, les éléments 113, le nihonium, et 115, le moscoivum. Alors que les premiers indices de la chimie du nihonium ont été rapportés, personne n'avait encore réussi à étudier la chimie du moscovium - où l'isotope le mieux adapté n'existe que pendant environ 20 centièmes de seconde.
Cet exploit vient d'être réalisé par une collaboration internationale au GSI Helmholtzzentrum für Schwerionenforschung à Darmstadt, en Allemagne. L'équipe a indiqué que les deux voisins, le nihonium et le moscovium, présentent une réactivité chimique plus élevée que le flérovium intermédiaire. L'effet local observé dans le plomb se retrouve donc également dans le flérovium, mais de manière beaucoup plus prononcée, ce qui n'est pas surprenant compte tenu de la charge nucléaire beaucoup plus élevée.
L'observation d'une poignée d'atomes a suffi pour obtenir ce résultat. Il a néanmoins fallu deux mois de travail continu, 24 heures sur 24, à l'accélérateur d'ions lourds du GSI/FAIR pour y parvenir. Pour produire les éléments superlourds, l'équipe a irradié des feuilles minces contenant de l'américium-243 (élément 95), lui-même un élément artificiel, avec des faisceaux d'ions intenses de calcium-48 (élément 20). Leur fusion a donné naissance à des noyaux de moscovium-288 (élément 115), qui se sont transformés en une fraction de seconde en nihonium-284 (élément 113).
Du gaz inerte a balayé les deux éléments à travers un ensemble de détecteurs recouverts d'une fine couche de quartz. Les détecteurs enregistrent la désintégration des atomes superlourds individuels et déterminent si les atomes forment une liaison chimique avec le quartz suffisamment forte pour les retenir à l'endroit où ils rencontrent la surface. Une liaison plus faible entraîne la poursuite du transport par le gaz. De cette manière, le motif enregistré dans le réseau de détecteurs fournit des informations sur la force des liaisons chimiques, et donc sur la réactivité chimique des éléments. Les éléments peu réactifs peuvent même sortir de la matrice, mais seulement pour rencontrer des détecteurs recouverts d'or. Les liaisons avec l'or sont généralement plus fortes qu'avec le quartz, ce qui garantit que chaque atome étudié est effectivement retenu et enregistré.
"Grâce à une nouvelle installation de séparation chimique et de détection combinée au séparateur électromagnétique TASCA, nos études de chromatographie en phase gazeuse ont pu être étendues à des éléments chimiques plus réactifs tels que le nihonium et le moscovium", explique le Dr Alexander Yakushev de GSI/FAIR, porte-parole de la collaboration internationale. "Nous avons réussi à augmenter l'efficacité et à réduire le temps nécessaire à la séparation chimique à tel point que nous avons pu observer le moscovium-288, qui a une durée de vie très courte, et sa fille, le nihonium-284, à un taux encore plus élevé d'environ deux atomes détectés chaque semaine.
Au total, quatre atomes de moscovium ont été enregistrés, tous dans le réseau recouvert de quartz. Parmi les 14 atomes de nihonium détectés, on a observé un dépôt principalement sur le quartz, ce qui indique la formation d'une liaison chimique. Un atome a atteint le réseau recouvert d'or, ce qui indique que la liaison avec le quartz n'est pas très forte. Ce comportement contraste avec celui des homologues plus légers que sont le thallium (pour le nihonium) et le bismuth (pour le moscovium), qui sont tous deux connus pour former des liaisons fortes avec le quartz. De même, le plomb, l'homologue du flérovium, forme des liaisons fortes avec le quartz, alors que le flérovium n'en forme pas.
L'ensemble des données relatives à ces éléments montre que les éléments superlourds sont beaucoup moins réactifs que leurs homologues plus légers, ce qui s'explique par l'inertie associée à l'apparition d'effets relativistes. L'effet le plus prononcé est observé localement au niveau du flérovium, qui est toujours un métal, mais qui réagit très faiblement - un comportement qui indique la présence de (sous-)enveloppes électroniques fermées, presque comme dans les gaz nobles non réactifs. Les résultats démontrent l'influence de la théorie de la relativité d'Einstein sur le tableau périodique et établissent en même temps un nouveau record pour l'élément le plus lourd jamais étudié chimiquement.
Les progrès technologiques font apparaître de nouvelles exigences en matière de matériaux. De nouveaux éléments pourraient-ils y contribuer ? À l'instar des voitures qui passent de l'énergie fossile à l'énergie électrique, d'autres objets de notre vie quotidienne disparaissent progressivement pour être remplacés par des technologies basées sur de nouveaux matériaux. Le premier appareil à base de flérovium n'est pas encore à la portée de la main. Seuls des atomes uniques par semaine - qui durent moins d'une seconde - peuvent actuellement être produits. Au fur et à mesure que la technologie progresse, cette situation pourrait changer, ce qui permettrait de disposer de plus grandes quantités. Nous ne savons pas s'ils pourront servir dans les futures batteries, comme agents médicaux, ou s'ils pourront enrichir nos vies de manière inconcevable aujourd'hui. Mais grâce aux expériences révolutionnaires menées à Darmstadt, les futurs chercheurs auront une longueur d'avance et connaîtront déjà les caractéristiques chimiques de ces nouveaux matériaux. Ce résultat ouvre également de nouvelles perspectives pour l'installation internationale FAIR (Facility for Antiproton and Ion Research), actuellement en construction à Darmstadt.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
A. Yakushev, J. Khuyagbaatar, Ch. E. Düllmann, M. Block, R. A. Cantemir, D. M. Cox, D. Dietzel, F. Giacoppo, Y. Hrabar, M. Iliaš, E. Jäger, J. Krier, ... L. G. Sarmiento, B. Schausten, U. Scherer, P. Thörle-Pospiech, N. Trautmann, M. Wegrzecki, P. Wieczorek; "Manifestation of relativistic effects in the chemical properties of nihonium and moscovium revealed by gas chromatography studies"; Frontiers in Chemistry, Volume 12, 2024-9-23






















































