Un catalyseur innovant produit du méthane en utilisant de l'électricité
Une étude ouvre de nouvelles voies pour la production de composés chimiques importants
Annonces
Des chercheurs de l'université de Bonn et de l'université de Montréal ont mis au point un nouveau type de catalyseur et l'ont utilisé dans leur étude pour produire du méthane à partir de dioxyde de carbone et d'eau de manière très efficace en utilisant de l'électricité. Le méthane peut être utilisé, par exemple, pour chauffer des appartements ou comme matière première dans l'industrie chimique. Il est également le principal composant du gaz naturel. S'il est produit à l'aide d'électricité verte, il est en grande partie neutre sur le plan climatique. Les connaissances acquises grâce au système modèle étudié par les chercheurs peuvent être transférées à des catalyseurs techniques à grande échelle. Le système pourrait également être utilisé pour produire d'autres composés chimiques importants. L'étude a été publiée récemment dans la prestigieuse revue "Nature Chemistry".
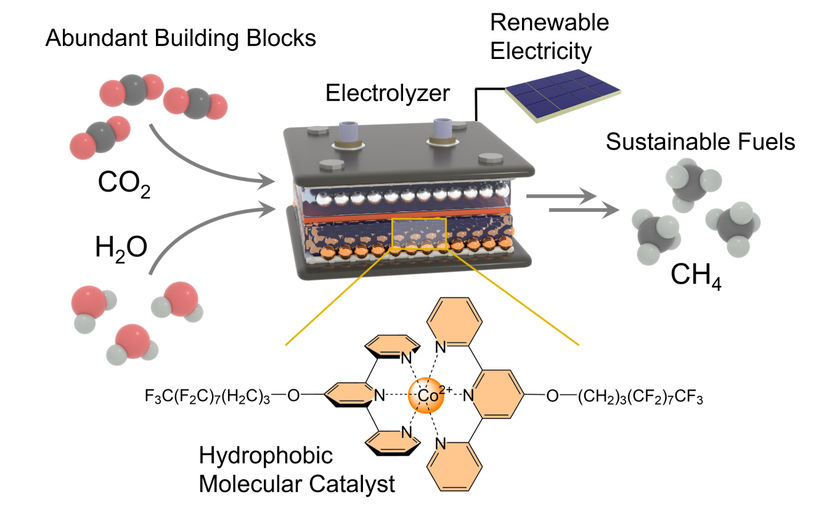
Le catalyseur hydrophobe (en bas) maintient les molécules de H2O dans l'électrolyseur (en haut) à l'écart du centre actif. Il extrait les atomes d'hydrogène de l'eau et les transporte vers le centre actif, où ils réagissent avec le carbone pour former du méthane.
Nikolay Kornienko
De nombreuses réactions chimiques nécessitent de l'énergie pour démarrer et cette énergie peut être ajoutée, par exemple, en chauffant les partenaires de la réaction ou en les soumettant à une pression élevée. "Nous avons utilisé l'électricité comme force motrice", explique le professeur Nikolay Kornienko. "En utilisant de l'électricité respectueuse du climat, nous pouvons produire, par exemple, du méthane qui ne contribue pas au réchauffement de la planète.
Le chercheur a récemment quitté l'Université de Montréal pour rejoindre l'Institut de chimie inorganique de l'Université de Bonn. Il a commencé sa dernière étude alors qu'il était encore au Canada et l'a terminée dans son nouveau lieu de résidence. "La production de méthane - dont la formule chimique est CH4 - est un défi car il est nécessaire d'effectuer une réaction entre un gaz et un liquide", explique M. Kornienko.
Dans ce cas, il s'agit de dioxyde de carbone (CO2) et d'eau (H2O). Les chercheurs ont utilisé une électrode de diffusion de gaz pour réunir ces deux partenaires. Dans la réaction, il est nécessaire de séparer les deux atomes d'oxygène (symbole chimique : O) de l'atome de carbone (C) et de les remplacer par quatre atomes d'hydrogène (H). L'hydrogène provient de l'eau.
Prévenir les réactions secondaires
Le problème de ce processus est que l'eau préfère subir une autre réaction et se divise en hydrogène et en oxygène dès qu'elle est exposée à un courant électrique. "Il s'agit d'une réaction concurrente que nous devons éviter", souligne Morgan McKee, l'assistant de Kornienko, qui a réalisé une grande partie des expériences. "Sinon, nous ne pourrions plus produire de méthane. Il faut donc éviter que l'eau entre en contact avec l'électrode. En même temps, nous avons toujours besoin de l'eau comme partenaire de réaction".
C'est là que le nouveau catalyseur, déposé sur l'électrode, entre en jeu. Il garantit avant tout que le dioxyde de carbone réagit plus facilement et plus rapidement pour produire du méthane. Il y parvient grâce à son "centre actif" qui retient le dioxyde de carbone et, en termes simples, affaiblit les liaisons entre l'atome de carbone et les deux atomes d'oxygène.
Ces atomes d'oxygène sont ensuite progressivement remplacés par quatre atomes d'hydrogène au cours de l'étape suivante. À ce stade du processus, le catalyseur a besoin d'eau. Mais il doit aussi la maintenir à distance pour éviter toute réaction secondaire indésirable. "Pour ce faire, nous avons lié de longues chaînes moléculaires latérales au centre actif", explique le professeur Kornienko, qui est également membre du domaine de recherche transdisciplinaire "Matter" de l'université de Bonn. "Leur structure chimique repousse l'eau ou, en d'autres termes, elles sont hydrophobes".
Chaînes moléculaires hydrophobes
Ce terme spécialisé vient du grec et signifie littéralement "avoir peur de l'eau". Les chaînes latérales ne se contentent pas d'éloigner les molécules de H2O du centre actif et de l'électrode, elles agissent également comme une sorte de tapis roulant. Au sens figuré, elles arrachent les atomes d'hydrogène aux molécules d'eau et les transportent vers le centre actif, où ils réagissent avec l'atome de carbone. Le CO2 est ainsi transformé en CH4 en plusieurs étapes.
Ce processus a un rendement de plus de 80 % et la réaction ne produit pratiquement pas de produits secondaires indésirables. Néanmoins, le catalyseur n'est pas vraiment adapté à la production de méthane à grande échelle. "Les principes de réaction que nous avons obtenus avec ce catalyseur pourraient toutefois être mis en œuvre dans d'autres matériaux catalytiques destinés à des applications techniques à grande échelle", explique Kornienko.
Le chercheur estime que la production de méthane n'est pas le seul domaine d'application de cette méthode. Selon lui, elle pourrait s'avérer plus lucrative dans la production d'autres composés chimiques tels que l'éthylène, qui est utilisé comme matière première pour de nombreuses matières plastiques. À moyen terme, la nouvelle méthode de catalyse pourrait donc être utilisée dans la mesure du possible pour rendre la production de plastique plus respectueuse de l'environnement.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Morgan McKee, Maximilian Kutter, Yue Wu, Hannah Williams, Marc-Antoine Vaudreuil, Mariolino Carta, Ashok Kumar Yadav, Harishchandra Singh, Jean-François Masson, Dieter Lentz, Moritz F. Kühnel, Nikolay Kornienko; "Hydrophobic assembly of molecular catalysts at the gas–liquid–solid interface drives highly selective CO2 electromethanation"; Nature Chemistry, 2024-10-4











































