La clé d'une eau plus propre
Les ingénieurs de Pitt, Drexel et Brookhaven résolvent le mystère "catalyse vs corrosion" dans la production électrochimique d'ozone
Des chercheurs de l'université de Pittsburgh et de l'université Drexel de Philadelphie, ainsi que du Brookhaven National Laboratory, s'efforcent de résoudre un mystère en plusieurs parties afin de rendre les traitements de désinfection de l'eau plus durables.

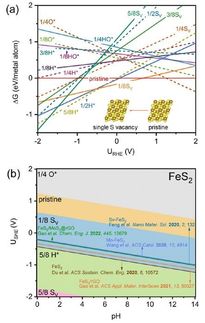
Une représentation de la production électrique d'ozone et l'étude de ce qui se passe réellement au niveau moléculaire.
John Keith
Les technologies de production électrochimique d'ozone (EOP) évolutives pour désinfecter les eaux sales pourraient un jour remplacer les traitements au chlore centralisés utilisés aujourd'hui, que ce soit dans les villes modernes ou dans les villages isolés. Cependant, on connaît mal la production électrochimique d'ozone au niveau moléculaire et la manière dont les technologies qui la rendent possible peuvent être rendues efficaces, économiques et durables.
Leur recherche, intitulée "Interplay between Catalyst Corrosion and Homogeneous Reactive Oxygen Species in Electrochemical Ozone Production" (Interaction entre la corrosion du catalyseur et les espèces réactives homogènes de l'oxygène dans la production électrochimique d'ozone), a été publiée récemment dans la revue ACS Catalysis. L'auteur principal est Rayan Alaufey, doctorant à Drexel, et des chercheurs de Drexel y ont contribué, notamment Maureen Tang, professeur agrégé de génie chimique et biologique, Andrew Lindsay, chercheur postdoctoral, Tana Siboonruang, étudiante en doctorat, et Ezra Wood, professeur agrégé de chimie ; John A. Keith, professeur agrégé de génie chimique et pétrolier, et Lingyan Zhao, étudiante diplômée à Pitt ; et Qin Wu, de Brookhaven.
"Les gens utilisent le chlore pour traiter l'eau potable depuis le19e siècle, mais aujourd'hui nous comprenons mieux que le chlore n'est pas toujours la meilleure option. L'EOP, par exemple, peut générer de l'ozone, une molécule ayant à peu près le même pouvoir désinfectant que le chlore, directement dans l'eau. Contrairement au chlore qui persiste de manière stable dans l'eau, l'ozone dans l'eau se décompose naturellement après environ 20 minutes, ce qui signifie qu'il est moins susceptible d'endommager les personnes qui consomment de l'eau au robinet, qui nagent dans une piscine ou qui nettoient des plaies dans un hôpital", a expliqué M. Keith, qui est également R.K. Mellon Faculty Fellow en énergie à l'école d'ingénierie Swanson de Pitt.
"L'utilisation du POE pour une désinfection durable aurait beaucoup de sens sur certains marchés, mais il faut pour cela un catalyseur suffisamment bon, et comme personne n'a encore trouvé un catalyseur de POE suffisamment bon, le POE est trop cher et trop gourmand en énergie pour être utilisé à plus grande échelle. Mes collègues et moi avons pensé que si nous pouvions décoder au niveau atomique ce qui fait fonctionner un catalyseur EOP médiocre, nous pourrions peut-être concevoir un catalyseur EOP encore meilleur".
Il est essentiel de percer le mystère du fonctionnement des catalyseurs EOP pour comprendre comment mieux concevoir l'un des catalyseurs EOP les plus prometteurs et les moins toxiques connus à ce jour : l'oxyde d'étain dopé au nickel et à l'antimoine (Ni/Sb-SnO2, ou NATO).
Selon Keith, c'est là que réside l'énigme : quel est le rôle de chaque atome dans l'oxyde d'étain dopé au nickel et à l'antimoine pour contribuer à l'EOP ? L'ozone se forme-t-il par catalyse comme nous le souhaitons, ou se forme-t-il parce que le catalyseur se décompose et que des travaux futurs doivent être menés pour rendre les catalyseurs NATO plus stables ?
De manière surprenante, les chercheurs ont découvert qu'il s'agissait probablement d'un mélange des deux.
En utilisant des analyses électrochimiques expérimentales, la spectrométrie de masse et la modélisation informatique de la chimie quantique, les chercheurs ont créé un "scénario à l'échelle atomique" pour expliquer comment l'ozone est généré sur les électrocatalyseurs de l'OTAN. Pour la première fois, ils ont identifié qu'une partie du nickel contenu dans l'OTAN est probablement lessivée des électrodes par la corrosion, et que ces atomes de nickel, qui flottent maintenant dans la solution à proximité du catalyseur, peuvent favoriser les réactions chimiques qui finissent par générer de l'ozone.
"Si nous voulons fabriquer un meilleur électrocatalyseur, nous devons comprendre quelles sont les parties qui fonctionnent et celles qui ne fonctionnent pas. Des facteurs tels que la lixiviation des ions métalliques, la corrosion et les réactions en phase de solution peuvent donner l'impression qu'un catalyseur fonctionne d'une certaine manière, alors qu'en réalité il fonctionne d'une autre manière".
Keith note que l'identification de la prévalence de la corrosion et des réactions chimiques se produisant loin du catalyseur sont des étapes importantes à clarifier avant que d'autres chercheurs puissent apporter des améliorations à l'EOP et à d'autres processus électrocatalytiques. Dans leur conclusion, ils notent que "l'identification ou la réfutation de l'existence de telles contraintes technologiques fondamentales sera essentielle pour toute application future de l'EOP et d'autres processus d'oxydation électrochimique avancés".
"Nous savons que le traitement électrochimique de l'eau fonctionne à petite échelle, mais la découverte de meilleurs catalyseurs le fera passer à l'échelle mondiale. L'étape suivante consiste à trouver de nouvelles combinaisons atomiques dans les matériaux qui sont plus résistants à la corrosion mais qui favorisent également un traitement électrochimique de l'eau économiquement et durablement viable", a déclaré M. Keith.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.