La puissance des nitrogénases : de nouvelles voies pour une production durable d'engrais
Nouvelles cibles pour l'amélioration des biocatalyseurs
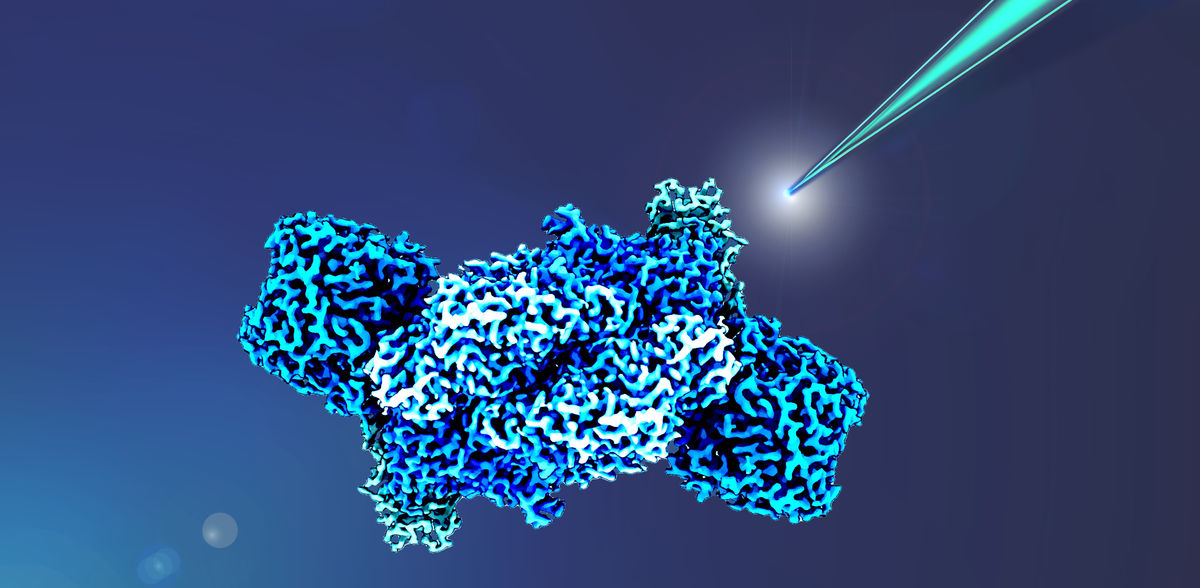
Les nitrogénases sont considérées comme des candidats prometteurs pour la production enzymatique durable d'Ammoniac et de composés carbonés. L'un des goulots d'étranglement de ce processus complexe, l'approvisionnement des enzymes en électrons, est resté mystérieux jusqu'à présent. Une équipe de l'Institut Max Planck de microbiologie terrestre de Marburg a découvert deux transporteurs d'électrons essentiels dont les protéines jouent un rôle clé dans la détermination des performances de la nitrogénase à fer (Fe), ouvrant ainsi de nouvelles possibilités d'élucidation et d'optimisation du potentiel de la nitrogénase.
Les nitrogénases sont des catalyseurs de plusieurs réactions industrielles, dont la plus importante est la fixation chimique et la conversion de N2 en ammoniac, une matière première pour les engrais. Leur production industrielle est actuellement réalisée à l'aide du procédé Haber-Bosch, nocif pour l'environnement. Les engrais produits de manière enzymatique et durable pourraient permettre d'économiser environ un pour cent de l'énergie consommée dans le monde et des émissions de CO2 qui y sont associées, raison pour laquelle de nombreux laboratoires de recherche et start-ups s'intéressent à ce sujet. Cependant, la recherche sur les nitrogénases est un défi car les nitrogénases sont des métalloenzymes très complexes et de nombreux aspects de leur réactivité et de leur catalyse sont encore mal compris.
La nitrogénase à fer (Fe) fixe non seulement l'azote, mais aussi leCO2
Des chercheurs dirigés par le Dr Johannes Rebelein de l'Institut Max Planck de microbiologie terrestre de Marburg, en Allemagne, ont maintenant obtenu les premières informations sur l'approvisionnement en énergie du complexe enzymatique, c'est-à-dire son approvisionnement en électrons. Leurs résultats sont importants non seulement pour la fixation industrielle du N2, mais aussi pour la fixation industrielle duCO2, car la même équipe a récemment montré que les nitrogénases à fer (Fe) sont également capables de convertir leCO2 en hydrocarbures à chaîne courte. Les chercheurs ont caractérisé le transport d'électrons vers la Fe-nitrogenase dans la bactérie modèle Rhodobacter capsulatus et ont montré que deux protéines différentes de transport d'électrons, appelées ferrédoxines, sont essentielles pour la fixation du N2.
Le goulot d'étranglement énergétique ouvre la voie à de nouvelles approches d'optimisation
"Nous voulions savoir quelles ferrédoxines sont cruciales pour la catalyse de la nitrogénase. Étant donné que toutes les cellules abritent plusieurs ferrédoxines, notre bactérie modèle R. capsulatus produisant six ferrédoxines différentes, nous voulions également savoir si plusieurs de ces ferrédoxines pouvaient effectuer la même tâche ou si elles avaient des fonctions strictement spécifiques", explique Holly Addison, premier auteur de l'étude. "Lorsque deux ferrédoxines spécifiques ont été éliminées, les autres n'ont pas pu reprendre leurs fonctions. Nous en avons conclu que ces ferrédoxines étaient essentielles et qu'elles jouaient probablement des rôles distincts dans la fixation de l'azote."
L'approvisionnement en électrons est considéré comme un goulot d'étranglement dans la catalyse. Avec les deux ferrédoxines, les chercheurs ont maintenant identifié des cibles claires pour influencer le flux d'électrons et donc la performance des nitrogénases en tant que biocatalyseurs.
"Nos résultats constituent une condition préalable importante pour l'optimisation de R. capsulatus en tant que système modèle pour la conversion améliorée de N2 ou deCO2 en ammoniac ou en hydrocarbures à chaîne courte", ajoute Johannes Rebelein. "L'objectif est maintenant d'approfondir l'étude et l'ingénierie des nitrogénases et de leurs protéines associées afin d'élargir notre compréhension et de permettre la production de produits chimiques industriels en vrac."
Les prochaines étapes du projet consisteront à mieux comprendre le rôle des ferrédoxines et à utiliser des méthodes de biologie synthétique pour les modifier et accélérer le renouvellement de l'enzyme nitrogénase en fournissant des électrons plus efficacement.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.