Les orbitales moléculaires déterminent la stabilité
Les résultats pourraient également aider l'industrie à optimiser la stabilité des polymères de coordination
Les dianions d'acides carboxyliques (fumarate, maléate et succinate) jouent un rôle dans la chimie de coordination et, dans une certaine mesure, dans la biochimie des cellules corporelles. Une équipe de HZB à BESSY II a maintenant analysé leurs structures électroniques en utilisant RIXS en combinaison avec des simulations DFT. Les résultats fournissent des informations non seulement sur les structures électroniques mais aussi sur la stabilité relative de ces molécules, ce qui peut influencer le choix des dianions carboxylates par l'industrie, en optimisant à la fois la stabilité et la géométrie des polymères de coordination.
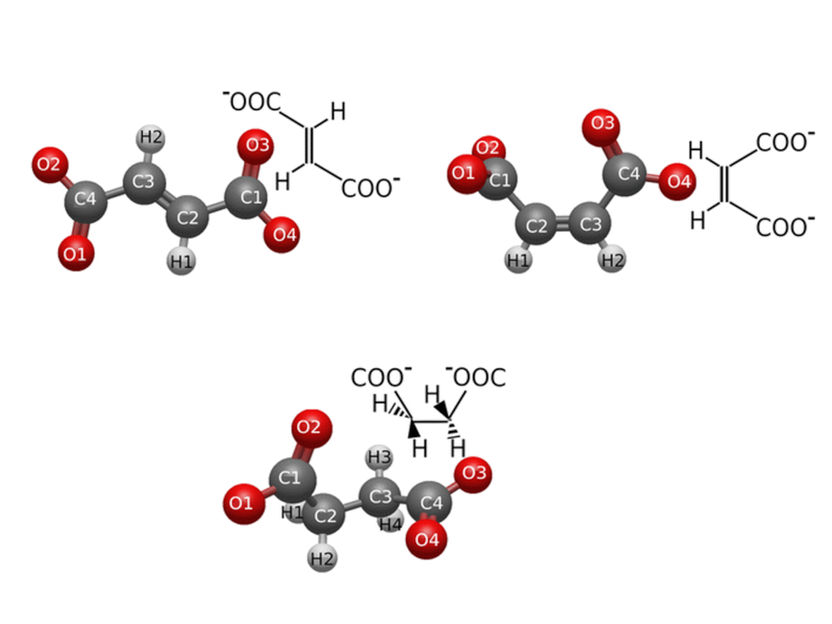
Structures géométriques moléculaires des isomères trans et cis du fumarate et du maléate (en haut, de gauche à droite) et de leur molécule hydrogénée, les dianions de succinate (en bas).
© HZB
Les dianions d'acide carboxylique de type C4H2O4 ou C4H4O4 (fumarate, maléate et succinate) peuvent avoir différentes géométries (cis ou trans) et différentes propriétés. Certaines variantes sont essentielles en chimie de coordination, incorporant des éléments métalliques dans des composés organiques, tandis que d'autres variantes jouent un rôle dans les processus biologiques. Le fumarate et le succinate, par exemple, sont formés comme produits intermédiaires dans les mitochondries des cellules. Le maléate, quant à lui, qui n'est généralement pas formé dans les processus naturels, est utilisé dans des applications industrielles qui nécessitent des matériaux durables. Pour des raisons environnementales, la question se pose toutefois de savoir si ces composés sont éternels ou biodégradables.
La stabilité des dianions fumarate, maléate et succinate n'est pas seulement influencée par leurs géométries moléculaires, mais aussi par la structure électronique des molécules, en particulier l'orbitale moléculaire la plus occupée (HOMO) et l'orbitale moléculaire inoccupée la plus basse (LUMO). Cependant, l'influence des orbitales moléculaires sur la stabilité de ces molécules n'a pas été étudiée.
RIXS et XAS à BESSY II
Alexander Föhlisch a élucidé l'influence de la structure électronique sur la stabilité des dianions fumarate, maléate et succinate. "Nous avons analysé ces composés à BESSY II à l'aide de deux méthodes différentes et très puissantes", explique le Dr Viktoriia Savchenko, premier auteur de l'étude. La spectroscopie d'absorption des rayons X (XAS) permet d'étudier les états électroniques inoccupés d'un système, tandis que la diffusion inélastique résonante des rayons X (RIXS) fournit des informations sur les orbitales les plus élevées occupées et sur les interactions entre les orbitales HOMO-LUMO. Les résultats peuvent être mis en relation avec les propriétés macroscopiques, en particulier la stabilité.
Le maléate potentiellement moins stable
L'analyse des données spectrales montre que le maléate est potentiellement moins stable que le fumarate et le succinate. De plus, l'analyse explique également pourquoi : le maléate est potentiellement moins stable que le fumarate et le succinate : L'analyse explique également pourquoi : La densité électronique dans l'orbitale HOMO au niveau de la liaison C=C entre les groupes carboxylates pourrait conduire à une liaison plus faible du maléate avec les molécules ou les ions. Le fumarate et le succinate, en revanche, pourraient être plus stables, car leurs orbitales HOMO sont également délocalisées.
"Cela signifie qu'il est possible que le maléate soit dégradé par certaines substances", explique Mme Savchenko.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.




















































