Des électrons lents pour des réactions plus efficaces
La nouvelle méthode permettra d'améliorer l'analyse des dommages causés par les radiations et d'optimiser certaines réactions chimiques.
Des chercheurs ont réussi à produire des électrons lents dans une solution. À l'avenir, ces électrons pourraient contribuer à rendre certaines réactions chimiques plus efficaces.
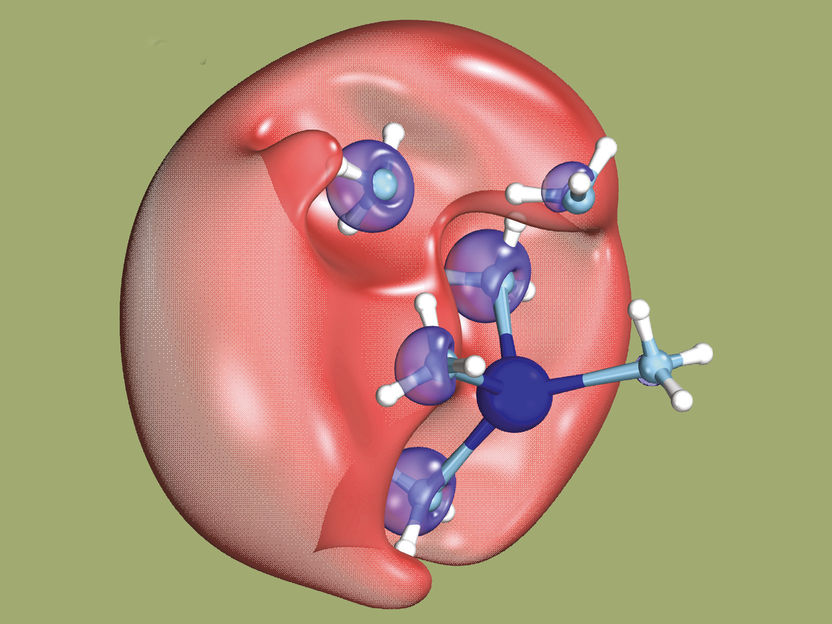
Ici, deux électrons sont brièvement réunis sous la forme d'un diélectron (rouge) entouré de molécules de solvant. Le diélectron ne peut pas être localisé plus précisément. L'un des électrons quittera ensuite cette zone.
Hartweg S et al. Science 2023
L'objectif de l'équipe internationale de chercheurs était en fait de détecter un objet chimique mystérieux : un diélectron en solution. Un diélectron est composé de deux électrons, mais contrairement à un atome, il n'a pas de noyau. Jusqu'à présent, les scientifiques n'ont pas été en mesure de détecter directement un tel objet. Alors que les chercheurs dirigés par Ruth Signorell, professeur à l'ETH Zurich, faisaient des expériences sur les diélectrons, ils ont accidentellement découvert un nouveau processus de production d'électrons lents. Ceux-ci peuvent être utilisés pour initier certaines réactions chimiques.
Les diélectrons sont instables. Ils se séparent à nouveau en deux électrons en moins d'un trillionième de seconde. Comme les chercheurs ont pu le montrer, l'un de ces électrons reste sur place, tandis que l'autre - qui a une faible énergie et est donc relativement lent - s'éloigne. La particularité de la nouvelle méthode est qu'elle permet aux chercheurs de contrôler l'énergie cinétique de cet électron et donc sa vitesse.
Les diélectrons occupent des cavités
Mais commençons par le commencement : pour produire les diélectrons, les chercheurs ont dissous du sodium dans de l'ammoniac (liquide) et ont exposé cette solution à la lumière UV. Cette exposition fait qu'un électron d'une molécule d'ammoniac rejoint un électron d'un atome de sodium et forme ainsi un diélectron. Le diélectron occupe brièvement une minuscule cavité dans la solution. Les chercheurs ont réussi à montrer que lorsque le diélectron se sépare, l'un des électrons s'éloigne à une vitesse déterminée par la longueur d'onde de la lumière UV utilisée. "Une partie de l'énergie de la lumière UV a été transférée à l'électron", explique M. Signorell.
Les chercheurs de l'ETH Zurich ont effectué ce travail en collaboration avec des chercheurs de l'université de Fribourg en Allemagne, du synchrotron SOLEIL en France et de l'université d'Auburn aux États-Unis.
Examen des réactions et des dommages causés par les rayonnements
Ces électrons à faible énergie cinétique sont intéressants à plus d'un titre. L'une d'entre elles est que les électrons lents causent des dommages aux tissus humains sous l'effet des radiations. Des électrons mobiles peuvent se former dans ces tissus, par exemple sous l'effet des rayons X ou de la radioactivité. Ils peuvent alors se fixer sur les molécules d'ADN et déclencher des réactions chimiques. Produire plus facilement ces électrons lents en laboratoire permettra aux chercheurs de mieux étudier les mécanismes qui conduisent aux dommages causés par les radiations.
Mais le corps humain n'est pas le seul endroit où des réactions chimiques sont induites par un composé acceptant un électron libre. La production de cortisone synthétique et d'autres stéroïdes n'en est qu'un exemple.
La possibilité d'utiliser la lumière UV comme moyen relativement simple de produire des électrons lents directement dans une solution, et de contrôler l'énergie de l'électron, permettra de mieux examiner ces réactions à l'avenir. Les chimistes pourront même optimiser les réactions, par exemple en utilisant la lumière UV pour augmenter l'énergie cinétique des électrons.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.