Hydrogène vert : comment le fractionnement photoélectrochimique de l'eau peut devenir compétitif
La lumière du soleil peut être utilisée pour produire de l'hydrogène vert directement à partir de l'eau dans des cellules photoélectrochimiques (PEC). Jusqu'à présent, les systèmes basés sur cette "approche directe" n'ont pas été compétitifs sur le plan énergétique. Cependant, l'équilibre change dès qu'une partie de l'hydrogène de ces cellules PEC est utilisée in situ pour une réaction d'hydrogénation catalytique, ce qui entraîne la coproduction de produits chimiques utilisés dans les industries chimiques et pharmaceutiques. L'étude montre que le temps de retour énergétique de la production photoélectrochimique d'hydrogène "vert" peut être réduit de façon spectaculaire.
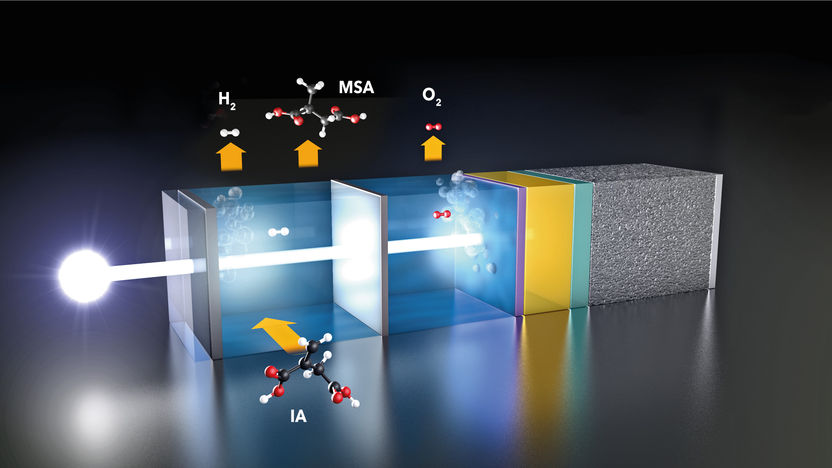
La cellule photoélectrochimique : La lumière du soleil génère une tension photoélectrique dans la cellule solaire recouverte d'un catalyseur (à droite), qui divise les molécules d'eau. L'hydrogène est produit à l'électrode gauche, l'oxygène à l'électrode droite. Une partie du H2 réagit ensuite avec l'acide itaconique (IA) pour former le précieux acide méthyl succinique (MSA).
© M. Künsting / HZB
L'hydrogène peut être produit par électrolyse de l'eau, l'idéal étant que des cellules solaires ou l'énergie éolienne fournissent l'énergie électrique nécessaire. Cet hydrogène "vert" devrait jouer un rôle important dans le système énergétique du futur. Au cours de la dernière décennie, la séparation solaire de l'eau a fait des progrès considérables : les meilleurs électrolyseurs, qui tirent la tension nécessaire de modules photovoltaïques ou de l'énergie éolienne, atteignent déjà des rendements allant jusqu'à 30 %. Il s'agit de l'approche indirecte.
L'approche directe
À l'Institut HZB pour les combustibles solaires, plusieurs équipes travaillent sur une approche directe de la séparation solaire de l'eau : elles développent des photoélectrodes qui convertissent la lumière du soleil en énergie électrique, sont stables dans les solutions aqueuses et favorisent de manière catalytique la séparation de l'eau. Ces photoélectrodes se composent d'absorbeurs de lumière qui sont intimement couplés à des matériaux catalytiques pour former le composant actif d'une cellule photoélectrochimique (PEC). Les meilleures cellules PEC basées sur des absorbeurs à oxyde métallique stables et peu coûteux atteignent déjà des rendements proches de 10 %. Bien que les cellules PEC soient encore moins efficaces que les électrolyseurs photovoltaïques, elles présentent également des avantages importants : dans les cellules PEC, par exemple, la chaleur de la lumière du soleil peut être utilisée pour accélérer davantage les réactions. Et comme les densités de courant sont dix à cent fois inférieures avec cette approche, il est possible d'utiliser des matériaux abondants et très peu coûteux comme catalyseurs.
Pas encore compétitif
Jusqu'à présent, les analyses technico-économiques (ATE) et les évaluations de l'énergie nette (ENE) ont montré que l'approche PEC n'est pas encore compétitive pour une mise en œuvre à grande échelle. L'hydrogène produit par les systèmes PEC coûte aujourd'hui environ 10 USD/kg, soit six fois plus que l'hydrogène produit par le reformage à la vapeur du méthane fossile (1,5 USD/kg). En outre, on estime que la demande cumulée d'énergie pour le fractionnement de l'eau par PEC est de 4 à 20 fois plus élevée que pour la production d'hydrogène à l'aide d'éoliennes et d'électrolyseurs.
L'idée : la coproduction de produits chimiques de valeur
"C'est là que nous voulions apporter une nouvelle approche", explique le Dr Fatwa Abdi de l'Institut HZB pour les combustibles solaires. Dans le cadre de la collaboration du réseau d'excellence UniSysCat entre le professeur Reinhard Schomäcker et le professeur Roel van de Krol, le groupe de Fatwa Abdi a étudié comment l'équilibre change lorsqu'une partie de l'hydrogène produit réagit avec l'acide itaconique (IA) dans le même réacteur(in situ) pour former de l'acide méthyl-succinique (MSA).
Délais de récupération de l'énergie
Les chercheurs ont d'abord calculé la quantité d'énergie nécessaire pour produire la cellule PEC à partir des absorbeurs de lumière, des matériaux catalytiques et d'autres matériaux tels que le verre, ainsi que la durée de fonctionnement nécessaire pour produire cette énergie sous forme d'énergie chimique comme l'hydrogène ou l'acide méthyl-succinique. Pour l'hydrogène seul, ce "temps de retour énergétique" est d'environ 17 ans dans l'hypothèse d'un rendement modeste de 5 % de l'énergie solaire sur l'hydrogène. Si seulement 2 % de l'hydrogène produit est utilisé pour convertir l'IA en MSA, le temps de retour énergétique est divisé par deux, et si 30 % de l'hydrogène est converti en MSA, l'énergie de production peut être récupérée au bout de deux ans seulement. "Cela rend le processus beaucoup plus durable et compétitif", explique M. Abdi. Une raison à cela : l'énergie nécessaire pour synthétiser le MSA dans une telle cellule PEC ne représente qu'un septième de l'énergie nécessaire aux procédés de production de MSA conventionnels.
Un système flexible
"Le système est flexible et peut également produire d'autres produits chimiques utiles dont le site a besoin", explique M. Abdi. L'avantage est que les composants fixes de l'unité PEC, qui représentent la majeure partie des coûts d'investissement, restent inchangés ; seuls le catalyseur d'hydrogénation et la matière première doivent être remplacés. "Cette approche permet de réduire considérablement le coût de production de l'hydrogène vert et d'accroître la faisabilité économique de la technologie PEC", explique M. Abdi. "Nous avons bien réfléchi au processus et la prochaine étape consistera à tester en laboratoire le fonctionnement pratique de la production simultanée d'hydrogène et de MSA.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.




















































