Identification d'intermédiaires chimiques clés dans la réaction polluant-carburant
Ces travaux permettront de convertir un polluant atmosphérique en carburant pour les véhicules et en matières premières chimiques pour l'industrie
Les chercheurs de l'université de Tsukuba et leurs partenaires ont mesuré expérimentalement l'hydrogénation du formiate adsorbé sur le métal. Ce développement facilitera la conversion pratique du dioxyde de carbone polluant en méthanol carburant.
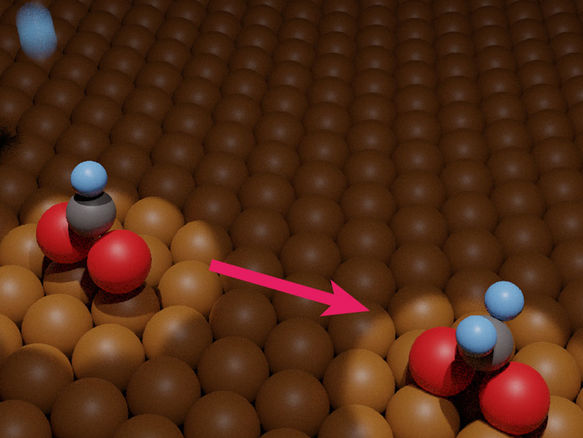
Les chercheurs de l'université de Tsukuba et leurs partenaires ont mesuré expérimentalement l'hydrogénation du formiate adsorbé sur le métal. Ce développement facilitera la conversion pratique du dioxyde de carbone polluant en méthanol carburant.
University of Tsukuba
La pollution par le dioxyde de carbone continue de modifier le climat mondial. Les chercheurs savent comment localiser cette pollution, même à l'échelle régionale et en temps quasi réel, comme le souligne cette année la revue Science Advances (22 avril). Dans le cadre d'une solution à la pollution par le dioxyde de carbone, de nombreuses études se concentrent sur la manière de convertir ce polluant en un carburant, tel que le méthanol. Les catalyseurs à base de cuivre sont un outil pour de telles conversions. La compréhension de la chimie correspondante, étape par étape, est essentielle pour optimiser la conversion du polluant dioxyde de carbone en méthanol carburant. Cependant, les détails de cette chimie restent flous ; des expériences sont nécessaires pour vérifier les hypothèses qui sont actuellement basées sur des simulations informatiques.
Dans une étude récemment publiée dans le Journal of the American Chemical Society, des chercheurs de l'université de Tsukuba et leurs partenaires ont mesuré expérimentalement l'hydrogénation du formiate adsorbé sur du cuivre. Cette étude aidera les chercheurs à optimiser les étapes critiques du processus susmentionné de transformation du polluant en carburant, et donc à accélérer la production de méthanol.
"L'hydrogénation du dioxyde de carbone en méthanol est une technologie clé potentielle pour la production de carburant et de matières premières chimiques, mais l'optimisation de la réaction reste difficile", explique le Dr Kotaro Takeyasu, auteur principal. "C'est parce qu'il est difficile de détecter expérimentalement les intermédiaires chimiques dans le mécanisme de réaction étape par étape."
La spectroscopie d'absorption par réflexion infrarouge et la désorption programmée en fonction de la température ont été essentielles pour obtenir deux résultats principaux. Premièrement, à une température de 200 Kelvin, l'exposition à l'hydrogène atomique correspondait à l'hydrogénation du formiate adsorbé. La nature chimique exacte du produit n'est pas encore claire. On a également constaté qu'à une température de 250 Kelvin, le formiate hydrogéné se décomposait à nouveau en formiate adsorbé ou en formaldéhyde gazeux, dans un rapport de 96:4.
"Sur la base de nos travaux expérimentaux et informatiques, l'énergie d'activation de l'hydrogénation du formiate adsorbé est d'environ 121 kilojoules par mole", déclare le Dr Takeyasu. "Nos résultats sont cohérents avec les résultats rapportés des études de synthèse du méthanol".
Les alliages cuivre-zinc sont particulièrement courants dans ce type de travaux. Le groupe de recherche examine actuellement comment les énergies d'activation rapportées dans la présente étude se comparent à des alliages catalytiques particulièrement utiles, qui nécessitent également des investigations expérimentales et computationnelles.
Les résultats de cette étude aideront les chercheurs à optimiser la production de méthanol à partir de dioxyde de carbone. Ces travaux permettront de convertir un polluant atmosphérique en carburant pour les véhicules et en matières premières chimiques pour l'industrie. Elle offre un moyen d'ajouter de la valeur au dioxyde de carbone, qui est généralement considéré comme un déchet. En optimisant la réaction d'hydrogénation décrite ici, les chercheurs pourraient disposer d'un nouvel outil pour exploiter au maximum des ressources limitées.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.