La lumière au lieu de l'électricité : Une nouvelle sorte d'"hydrogène vert"
Simple et prometteur
Aujourd'hui, l'hydrogène vert est généralement créé en fractionnant l'eau à l'aide de courant électrique provenant de sources d'énergie renouvelables. Les scientifiques de l'Université technique de Vienne ont mis au point un nouveau modèle de photocatalyseur qui pourrait rendre ce processus plus direct et plus contrôlable.
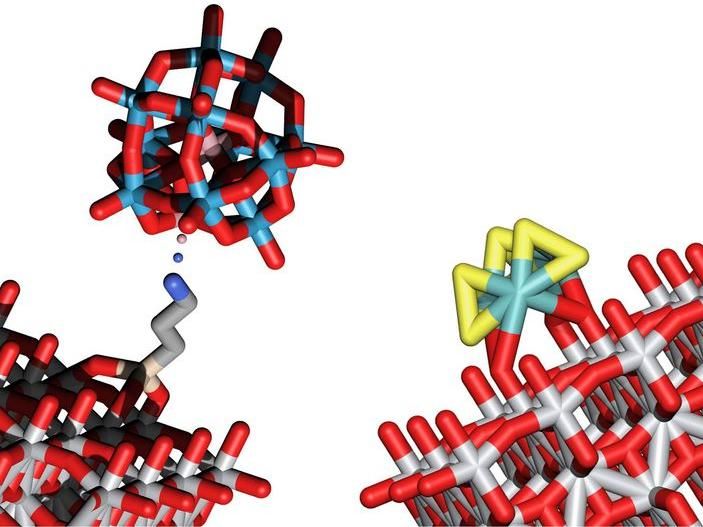
Modèles structurels de deux clusters qui permettent la séparation de l'eau en O2 et H2 au moyen de l'énergie lumineuse
Technische Universität Wien
L'hydrogène pourrait constituer une part importante de notre approvisionnement énergétique futur : Il peut être stocké, transporté et brûlé selon les besoins. Cependant, la majeure partie de l'hydrogène disponible aujourd'hui est un sous-produit de la production de gaz naturel - cela doit changer pour des raisons de protection du climat. La meilleure stratégie à ce jour pour produire de l'"hydrogène vert" respectueux de l'environnement consiste à séparer l'eau en hydrogène et en oxygène en utilisant de l'électricité provenant de sources d'énergie renouvelables, par exemple des cellules photovoltaïques.
Toutefois, il serait beaucoup plus facile d'utiliser directement la lumière du soleil pour fractionner l'eau. C'est exactement ce que de nouveaux catalyseurs rendent désormais possible, dans un processus appelé "séparation photocatalytique de l'eau". Le concept n'est pas encore utilisé industriellement. À l'Université technique de Vienne, des étapes importantes ont été franchies dans cette direction : à l'échelle atomique, les scientifiques ont mis au point une nouvelle combinaison de catalyseurs moléculaires et solides qui peuvent effectuer le travail en utilisant uniquement des matériaux relativement peu coûteux.
Interaction de différents atomes
"En fait, pour pouvoir séparer l'eau avec de la lumière, il faut résoudre deux problèmes en même temps", explique Alexey Cherevan, de l'Institut de chimie des matériaux de l'Université technique de Vienne. "Nous devons penser à l'oxygène et à l'hydrogène. Les atomes d'oxygène de l'eau doivent être transformés en molécules de O2, et les ions hydrogène restants - qui ne sont que des protons - doivent être transformés en molécules deH2."
Des solutions ont maintenant été trouvées pour ces deux tâches : De minuscules clusters inorganiques composés d'un petit nombre d'atomes seulement sont ancrés sur une surface de structures de support absorbant la lumière, comme l'oxyde de titane. La combinaison de clusters et de supports semi-conducteurs soigneusement choisis permet d'obtenir le comportement souhaité.
Les clusters responsables de l'oxydation de l'oxygène sont constitués de cobalt, de tungstène et d'oxygène, tandis que les clusters de soufre et de molybdène sont particulièrement adaptés à la création de molécules d'hydrogène. Les chercheurs de la TU Wien ont été les premiers à déposer ces clusters sur une surface en oxyde de titane, où ils peuvent agir comme catalyseurs pour la division de l'eau.
"L'oxyde de titane est sensible à la lumière, cela était déjà bien connu", explique Alexey Cherevan. "L'énergie de la lumière absorbée conduit à la création d'électrons libres et de charges positives libres dans l'oxyde de titane. Ces charges permettent ensuite aux amas d'atomes assis sur cette surface de faciliter la séparation de l'eau en oxygène et en hydrogène."
Un contrôle précis, atome par atome
"D'autres groupes de recherche travaillant sur la division de l'eau avec la lumière s'appuient sur des nanoparticules qui peuvent prendre des formes et des propriétés de surface très différentes", explique Alexey Cherevan. "Les tailles sont difficiles à contrôler, les atomes ne sont pas tout à fait disposés de la même manière. Par conséquent, dans ce cas, il n'est pas possible d'expliquer en détail comment se déroule le processus de catalyse." À la TU Wien, en revanche, la structure exacte des clusters est déterminée avec une précision atomique, ce qui permet de comprendre pleinement le cycle catalytique.
"C'est le seul moyen d'avoir un retour sur ce dont dépend réellement l'efficacité du processus", explique Alexey Cherevan. "Nous ne voulons pas nous contenter d'une approche par essais et erreurs et essayer différentes nanoparticules jusqu'à ce que nous trouvions la meilleure - nous voulons découvrir au niveau atomique ce qu'est réellement le catalyseur optimal."
Maintenant qu'il a été prouvé que les matériaux sélectionnés sont effectivement adaptés à la division de l'eau, la prochaine étape consiste à affiner leur structure exacte pour obtenir des rendements encore plus élevés.
Simple et prometteur
"L'avantage décisif de notre méthode par rapport à la division de l'eau par électrolyse est sa simplicité", souligne Alexey Cherevan. La production d'hydrogène électrique nécessite d'abord une source d'énergie durable - comme des cellules photovoltaïques, éventuellement un dispositif de stockage de l'énergie électrique et une cellule d'électrolyse. Au total, cela donne un système relativement complexe composé d'une multitude de matières premières. En revanche, pour la séparation photocatalytique de l'eau, il suffit d'une surface recouverte d'eau et irradiée par le soleil.
À long terme, ces connaissances pourraient également être utilisées pour produire des molécules plus complexes en utilisant le concept de photosynthèse artificielle. Il pourrait même être possible d'utiliser l'énergie du rayonnement solaire pour produire des hydrocarbures avec le dioxyde de carbone de l'atmosphère et de l'eau, qui pourraient ensuite être utilisés pour d'autres applications.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
S. Batool et al., Surface-Anchoring and Active Sites of [Mo3S13]2- Clusters as Co-Catalysts for Photocatalytic Hydrogen Evolution. ACS Catalysis, 2022, 12, 6641-6650.
S.P. Nandan et al., Immobilization of a [CoIIICoII(H2O)W11O39]7- Polyoxoanion for Photocatalytic Oxygen Evolution Reaction, ACS Materials Au, 2022, just accepted.






















































