Des scientifiques résolvent le mystère de la catalyse pour la production écologique de méthanol à partir de dioxyde de carbone
Une vue en direct de la synthèse du méthanol
Une équipe de recherche internationale dirigée par des chercheurs de l'Université de Stockholm a pu, pour la première fois, étudier la surface d'un catalyseur cuivre-zinc lors de la réduction du dioxyde de carbone en méthanol. Les résultats - obtenus à la source de lumière brillante PETRA III de DESY - sont publiés dans la revue scientifique Science. Une meilleure connaissance du processus catalytique de la synthèse du méthanol et la possibilité de trouver des matériaux encore plus efficaces ouvrent la porte à une transition verte dans l'industrie chimique.
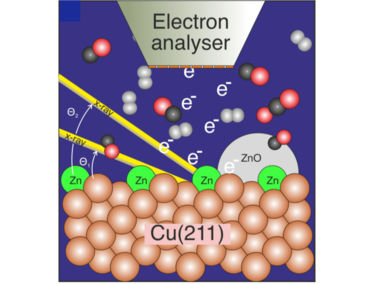
Image pour les initiés : le graphique montre une surface de cuivre du catalyseur recouverte d'une petite quantité de zinc, qui a été étudiée lors de la réaction du dioxyde de carbone, du monoxyde de carbone et de l'hydrogène en méthanol par spectroscopie photoélectronique.
Stockholm University
Le méthanol - l'alcool le plus simple - est actuellement l'un des produits chimiques de base les plus importants de la pétrochimie, avec une production annuelle de 110 millions de tonnes. Il peut être converti en des dizaines de milliers de produits différents et utilisé pour la fabrication, par exemple, de plastiques, de détergents, de produits pharmaceutiques et de carburants. Le méthanol a également le potentiel de devenir un futur vecteur d'énergie. Par exemple, le carburant pour l'aviation peut être produit en utilisant du dioxyde de carbone et de l'hydrogène capturés par électrolyse de l'eau au lieu d'utiliser du gaz naturel. Une future transformation verte de l'industrie chimique, similaire à celle de l'acier vert, où l'énergie éolienne ou solaire alimente les cellules électrolytiques, est donc envisageable.
La production industrielle de méthanol s'effectue dans un processus catalytique où un mélange de monoxyde de carbone (CO), de dioxyde de carbone (CO2) et d'hydrogène (H2) réagit pour donner du méthanol (CH3OH). Le catalyseur est constitué d'un mélange de cuivre, d'oxyde de zinc et d'oxyde d'aluminium. Cependant, la fonction sous-jacente et l'état chimique des composants du catalyseur pendant la réaction n'ont jamais été résolus - jusqu'à présent. "Le défi consistait à étudier expérimentalement la surface du catalyseur avec des méthodes sensibles à la surface dans des conditions de réaction réelles, à des pressions et des températures relativement élevées. Pendant de nombreuses années, ces conditions n'ont pas été réalisables et différentes hypothèses concernant la présence de zinc sous forme d'oxyde, de métal ou d'alliage avec le cuivre ont été émises, mais n'ont pu être vérifiées sans ambiguïté", explique Anders Nilsson, professeur de physique chimique à l'université de Stockholm.
"C'est fantastique que nous ayons pu faire la lumière sur ce sujet complexe de la formation de méthanol sur un catalyseur cuivre-zinc après de nombreuses années d'efforts", a déclaré Peter Amann, premier auteur de la publication.
Les études ont été réalisées sur la ligne de faisceau P22 de PETRA III, dédiée à l'étude de la structure électronique et atomique des surfaces, des interfaces et des matériaux en vrac par spectroscopie photoélectronique. "Ce qui est spécial, c'est que nous avons construit un instrument de spectroscopie photoélectronique à Stockholm qui permet d'étudier les surfaces de catalyseurs sous haute pression et donc d'observer directement ce qui se passe lorsque la réaction a lieu", explique David Degerman, doctorant en physique chimique à l'université de Stockholm. "Nous avons ouvert une nouvelle porte sur la catalyse avec notre nouvel instrument".
"La combinaison des paramètres du faisceau PETRA III et de l'instrument de spectroscopie innovant permet de réaliser des expériences in-operando sur les catalyseurs à des pressions dix fois supérieures à celles des autres sources de rayonnement synchrotron", explique Christoph Schlueter, scientifique de la ligne de faisceau P22 de DESY.
"Nous avons réussi, grâce à notre instrument, à démontrer que le zinc est allié au cuivre directement à la surface, ce qui fournit des sites atomiques spéciaux où le méthanol est créé à partir du dioxyde de carbone", explique Chris Goodwin, chercheur en physique chimique à l'université de Stockholm. "Au cours des processus industriels, une petite quantité de monoxyde de carbone est mélangée, ce qui empêche la formation d'oxyde de zinc à partir du dioxyde de carbone".
"Disposer de notre instrument de Stockholm à l'une des sources de rayons X les plus brillantes au monde, PETRA III à DESY à Hambourg, a été crucial pour mener à bien cette étude",explique Patrick Lömker,postdoc à l'Université de Stockholm. "Nous pouvons maintenant imaginer l'avenir avec des sources encore plus lumineuses lorsque la machine passera à PETRA IV".
Dans l'étude, les chercheurs ont pu déterminer différents comportements de la surface du catalyseur en fonction de la fraction de CO et deCO2 dans le mélange gazeux - un point de départ pour optimiser les catalyseurs existants ou même en trouver de meilleurs. "Nous disposons désormais des outils nécessaires pour mener des recherches menant à d'autres matériaux catalytiques susceptibles de mieux s'intégrer à l'hydrogène produit par électrolyse, en vue de la transition verte de l'industrie chimique, qui est aujourd'hui entièrement basée sur les énergies fossiles et représente 8 % des émissions mondiales de dioxyde de carbone", déclare Anders Nilsson.
L'étude a été menée par une collaboration entre l'université de Stockholm, l'université d'Innsbruck et l'université technique de Vienne, DESY et l'institut Fritz-Haber de Berlin.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.





















































