Le mécanisme des bactéries formatrices de glace
Des chercheurs découvrent le mécanisme de la bactérie responsable de la formation de la glace
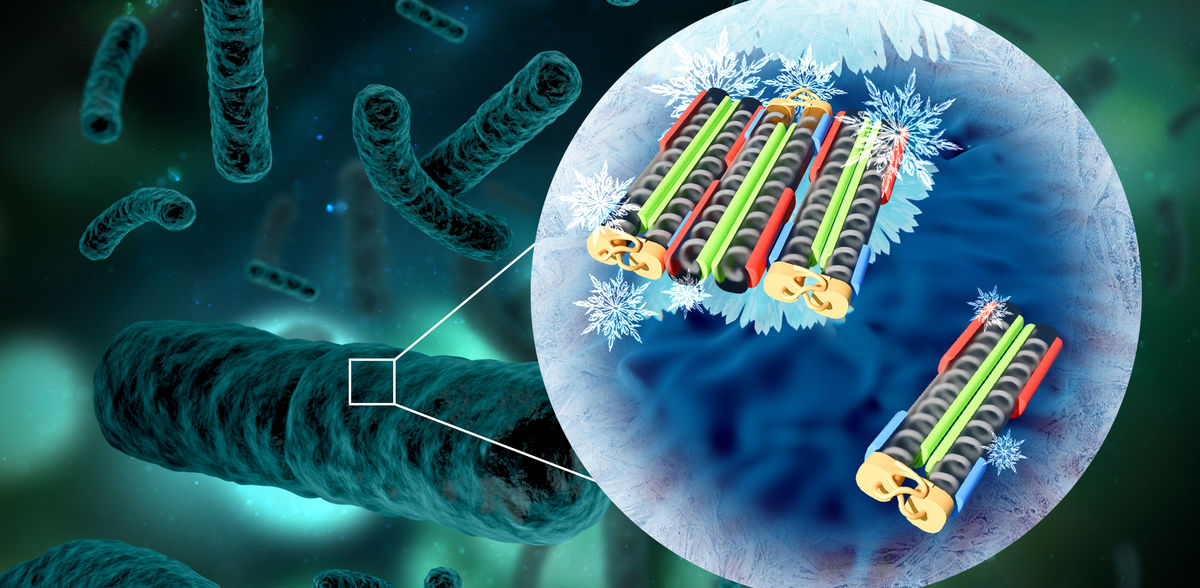
Des "protéines de nucléation de la glace" produites par certaines bactéries ont la capacité de contrôler le point de congélation de l'eau, avec une efficacité telle qu'aucun autre matériau connu ne peut rivaliser avec elles. Une équipe interdisciplinaire dirigée par Konrad Meister de l'Institut Max Planck pour la recherche sur les polymères a maintenant découvert comment ces protéines fonctionnent et comment leur activité peut être régulée avec précision. Leurs conclusions montrent qu'il suffit d'une poignée de protéines assemblées pour atteindre une activité maximale, et que ces protéines s'assemblent de préférence dans des conditions spécifiquement induites.
La congélation de l'eau ne nécessite pas seulement des températures inférieures à 0°C, mais aussi un noyau de glace initial pour déclencher la cristallisation. Sans ce noyau crucial, l'eau peut rester liquide grâce à un phénomène connu sous le nom de surfusion, même jusqu'à une température glaciale de -40°C. La nature a développé des mécanismes intrigants pour éviter la surfusion en favorisant la formation de noyaux de glace, en particulier chez certains types de bactéries. Ces micro-organismes utilisent des protéines spécialisées de nucléation de la glace (INP) situées sur leur membrane externe pour imiter les molécules d'eau et les transformer en structures semblables à de la glace. Mais pour servir de modèles efficaces aux cristaux de glace, plusieurs INP doivent s'assembler en agrégats. Les observations expérimentales suggèrent qu'il n'existe que deux tailles d'agrégats, la plus grande de ces structures hautement ordonnées permettant à l'eau de geler à des températures proches de 0°C.
Toutefois, le nombre de protéines nécessaires à la formation de ces agrégats et la manière dont ils s'assemblent n'étaient pas clairs. Des chercheurs dirigés par Konrad Meister, chef de groupe à l'Institut Max Planck pour la recherche sur les polymères et professeur à l'université d'État de Boise (États-Unis), se sont attaqués à ces questions par le biais d'une approche interdisciplinaire. Ils ont examiné de près l'activité des bactéries de l'espèce Pseudomonas syringae lorsqu'elles étaient refroidies à -30°C et ont découvert qu'il y avait plus que les deux classes d'agrégats initialement suspectées.
Étant donné que la structure exacte de l'INP reste indéterminée sur le plan expérimental, des prédictions structurelles de pointe ont été utilisées pour modéliser la structure de la protéine. L'équipe de recherche dirigée par Valeria Molinero, de l'université de l'Utah, s'en est servie comme base pour des méthodes informatiques de pointe afin de déterminer la taille critique des agrégats nécessaire à l'activité de congélation observée, ce qui a permis de mieux comprendre la relation entre la structure et la fonction des protéines.
La recherche a révélé que des dimères très stables, constitués de deux protéines, se forment initialement. Ces dimères agissent ensuite comme des blocs de construction, s'assemblant en structures plus grandes par le biais d'interactions électrostatiques. Fait remarquable, l'étude a révélé que des agrégats composés de seulement six protéines suffisent à déclencher le processus de congélation avec une efficacité exceptionnelle.
L'équipe interdisciplinaire de chercheurs a en outre trouvé un moyen de favoriser la formation d'agrégats plus importants en stabilisant le pH et en ajoutant des sels simples. Ces connaissances sont très utiles pour des applications telles que la production déjà établie de neige artificielle. "Pour la première fois, nous avons pu renforcer l'activité des nucléateurs de glace bactériens et améliorer leur stabilité face à des conditions environnementales fluctuantes", explique Galit Renzer, principal auteur de l'étude. "Cela ouvre non seulement de nouvelles perspectives pour des applications innovantes telles que la cryoconservation, mais fournit également des indications précieuses pour faire face aux impacts du changement climatique."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.