Des chimistes développent un nouveau réactif pour la délectronisation
Le réactif permet d'accéder à la classe des cations carbonylés de métaux de transition en grappe.
Des chimistes de Fribourg ont réussi à convertir des carbonyles polynucléaires de métaux de transition en leurs cations complexes homoleptiques en utilisant des oxydants inorganiques typiques. Dans leurs travaux, l'équipe de recherche composée de Malte Sellin, Christian Friedmann et du professeur Ingo Krossing de l'Institut de chimie inorganique et analytique ainsi que de Maximilian Mayländer et Sabine Richert de l'Institut de chimie physique de l'Université de Fribourg montrent que le dérivé de l'anthracène avec un potentiel de demi-pas de 1,42 volt par rapport à Fc0/+ peut être converti en sel délectronisant radicalaire par un sel de nitrosonium. "Nous avons ainsi repoussé un peu plus loin la frontière de la recherche fondamentale en chimie de coordination ainsi qu'en chimie organométallique", a déclaré M. Krossing. Le groupe de recherche a publié ses résultats dans la revue Chemical Science.
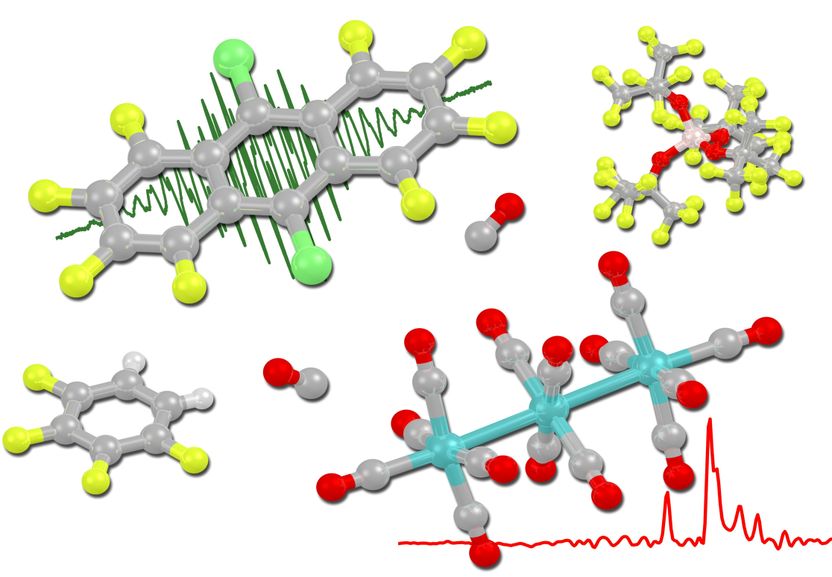
Les cations radicaux de perhaloanthracène désélectronisent les dodécacarbonyles trimétalliques sous la pression du monoxyde de carbone pour former les premiers cations de métaux de transition groupés.
Image: provided by the research group
Un désélectronateur fabriqué à partir d'un produit chimique commercial
Afin d'accéder à la classe jusqu'ici presque inconnue des cations carbonylés de métaux de transition en grappe, les chimistes de l'université de Fribourg ont cherché un moyen d'ioniser les substrats sans déclencher de réactions secondaires indésirables. Lors de l'ionisation, une molécule neutre perd un ou plusieurs électrons. En conséquence, une molécule chargée positivement, également appelée cation, est formée. Un désélectroniseur dit innocent est un agent d'ionisation qui n'accepte que les électrons du substrat et ne présente par ailleurs aucune autre réactivité indésirable. Étant donné que le seul désélectroniseur innocent connu à ce jour, un cation ammoniumyle perfluoré, nécessite une synthèse laborieuse et longue, les scientifiques de Fribourg ont mis au point une alternative qui est produite directement à partir d'un produit chimique disponible dans le commerce : le dérivé de l'anthracène, avec un potentiel de demi-étape de 1,42 volt par rapport à Fc0/+, peut être converti en sel désélectroniseur radicalaire par un sel de nitrosonium. "Le sel désélectronisant nous permet d'enlever des électrons du système tout en préservant la structure. Il est donc particulièrement doux et crée des systèmes que nous n'avons pas pu représenter auparavant. À long terme, cela pourrait nous aider à produire de meilleurs catalyseurs", explique Krossing.
Le délectroniseur d'anthracène perhalogéné est putatif
Dans un premier temps, le groupe de recherche a essayé de générer les cations carbonyles de métaux de transition souhaités en faisant réagir des dodécacarbonyles trimétalliques avec un sel d'argent comme oxydant. La réaction directe des dodécacarbonyles trimétalliques avec des cations nitrosyle n'a pas non plus donné le résultat escompté. "Cependant, si le cation nitrosyle est mis en réaction au préalable avec un dérivé perhalogéné de l'anthracène, le cation radicalaire acène résultant désélectronise les dodécacarbonyles trimétalliques sous atmosphère de monoxyde de carbone et conduit aux sels souhaités", explique Sellin. "Jusqu'à présent, personne n'a réussi à convertir les carbonyles polynucléaires de métaux de transition en leurs cations complexes homoleptiques par des oxydants inorganiques typiques. Nous avons maintenant démontré que c'est possible", déclare M. Krossing. Sellin ajoute : "De manière surprenante, la caractérisation structurelle ainsi que les spectroscopies par résonance magnétique nucléaire et vibrationnelle de notre nouveau cluster indiquent trois ligands carbonyles fortement différents électroniquement. Nous avons été surpris de constater un comportement électronique aussi différent de pratiquement les mêmes ligands dans une seule molécule."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.



















































