Les microbes alimentés par la lumière sont des usines chimiques super-productives
Une nouvelle méthode permet aux bactéries d'utiliser la lumière comme énergie externe pour accélérer la bioproduction de composés cibles sans perturber le métabolisme naturel du micro-organisme hôte.
Le partage est essentiel à la vie en société, qu'il s'agisse de jouets partagés par des enfants en bas âge ou de ressources naturelles partagées par les nations ; mais on ne peut éviter le fait qu'une partie qui obtient plus signifie que l'autre partie obtient moins. Aujourd'hui, des chercheurs de l'université d'Osaka, en collaboration avec l'université de Shizuoka et l'université de Kobe, ont trouvé un moyen de contourner la nécessité de partager l'énergie dans la biofabrication, afin que les voies cellulaires dédiées à la génération du produit obtiennent toujours plus.
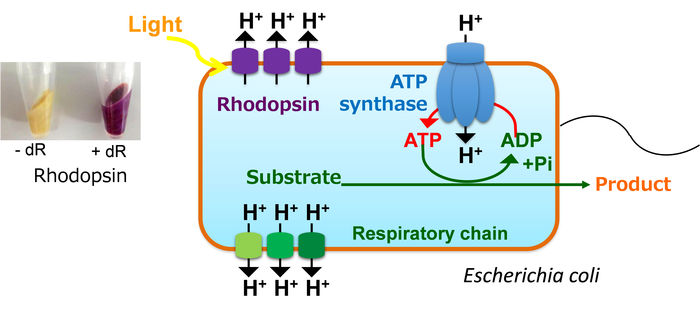
En général, E. coli pompe des protons dans l'espace extracellulaire par la chaîne respiratoire en consommant des atomes de carbone dans le cycle TCA, produit de l'ATP par l'ATP synthase en utilisant le gradient de protons généré à travers la membrane, et dirige diverses activités métaboliques en utilisant l'ATP. En revanche, notre E. coli modifié exprimant la rhodopsine peut pomper le proton en utilisant l'énergie lumineuse et produire de l'ATP sans perdre d'atomes de carbone sous forme de CO2. Par conséquent, la cellule peut effectivement produire certains produits chimiques utiles qui nécessitent de l'ATP pour leur synthèse.
Kiyotaka Y. Hara
Dans une étude publiée récemment dans Metabolic Engineering, les chercheurs ont révélé que des micro-organismes peuvent être modifiés pour utiliser la lumière comme source d'énergie, libérant ainsi des ressources cellulaires pour la fabrication de produits bioproduits.
Les micro-organismes modifiés par génie métabolique sont utilisés pour produire divers produits chimiques utiles dans le monde entier, mais il y a un hic : la croissance microbienne et la synthèse chimique nécessitent toutes deux une molécule appelée ATP comme source d'énergie. Pour cette raison, le maintien en bonne santé des "usines" cellulaires limite la production chimique.
"Les micro-organismes qui produisent des substances utiles sont généralement développés en modifiant le métabolisme pour convertir l'énergie qui serait normalement utilisée pour la croissance en une ressource pour synthétiser ces substances cibles", explique Yoshihiro Toya, premier auteur de l'étude. "Nous avons pensé que nous pourrions plutôt utiliser la lumière, une source d'énergie externe, pour améliorer la production de substances utiles sans perturber le métabolisme naturel des micro-organismes."
Pour tester cela, les chercheurs ont introduit une protéine membranaire hétérologue appelée rhodopsine dans Escherichia coli, un micro-organisme communément utilisé dans la bioproduction. La rhodopsine est une pompe qui est activée par la lumière. L'action de la pompe conduit à la génération d'ATP sans utiliser les mécanismes naturels de la cellule (connus sous le nom de cycle TCA et de chaîne respiratoire) pour le produire. Cette approche présente l'avantage supplémentaire de réduire l'émission de dioxyde de carbone, un sous-produit du cycle TCA.
"Les résultats ont clairement montré le succès de notre stratégie", déclare Kiyotaka Y. Hara, chef de projet. "Les cellules exprimant la rhodopsine ont généré beaucoup plus de produits chimiques lorsqu'elles étaient exposées à la lumière, et le flux de carbone dans ces cellules a été détourné de la production d'énergie pour être dirigé vers la synthèse chimique."
Après avoir prouvé que ce concept fonctionnait pour divers composés tels que le 3-hydroxypropionate, le mévalonate et le glutathion, les chercheurs ont créé trois nouvelles souches d'E. coli. L'une de ces souches exprimait des super-rhodopsines avec des activités de pompage encore meilleures que la rhodopsine originale testée ; cette souche a été développée par le groupe du Dr Toya à l'université d'Osaka. Les deux autres souches incorporaient des systèmes biologiques synthétiques qui fournissaient un apport intrinsèque de rétinal, l'activateur de la rhodopsine, et optimisaient l'expression équilibrée de plusieurs gènes dans la voie métabolique pertinente ; ces souches ont été établies par le groupe du Dr Jun Ishii à l'Université de Kobe. Enfin, le groupe du Dr Hara à l'université de Shizuoka a intégré tous ces systèmes dans une seule souche d'E. coli qui produit un produit chimique en fonction de la lumière.
"Nos résultats suggèrent que des micro-organismes bioproduits conçus pour utiliser la lumière comme source d'énergie peuvent être utilisés pour biosynthétiser efficacement des composés cibles utiles", déclare le Dr Hara.
Cette nouvelle approche devrait permettre d'accroître l'efficacité de la production de matériaux utiles par fermentation et autres bioprocédés, tout en réduisant les émissions de carbone.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.






















































